GxP en Startups
GxP suena a “corporativo”, o peor: “burocrático” (hay quienes dicen que GMP es “Gran Montaña de Papeles” o “Give Me Paper”) y obviamente nadie fundó una start up para llenar formularios.
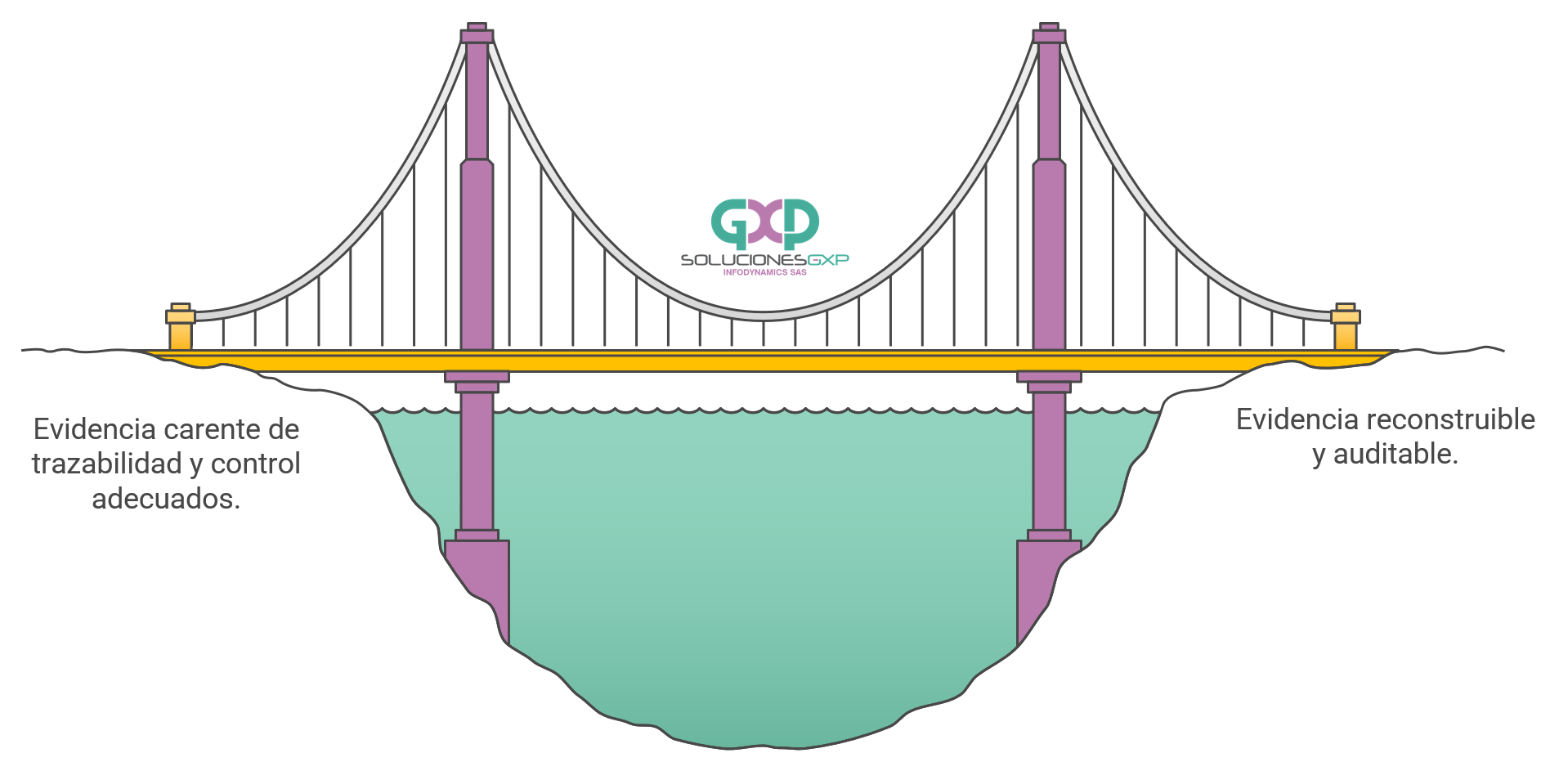
Pero en una start up de ciencias de la vida no es eso. Es la diferencia entre tener resultados interesantes y tener evidencia utilizable.
La ciencia produce datos. Su empresa necesita que esos datos sean trazables, defendibles y transferibles: que un tercero (regulador, partner, inversor, CDMO/CRO) pueda entender qué se hizo, con qué versión, quién lo hizo y por qué se puede confiar.
Si las GxP entran tarde, normalmente no se “arregla” con un documento: se soluciona repitiendo trabajo, reconstruyendo archivos, renegociando con proveedores o frenando avances.
Esto pasa en la vida real. No es un “pitch” armado para conseguir clientes.
A modo de ejemplo:
- En preclínico, cuando QA y trazabilidad no están bien gestionados internamente o el tercerista no fue bien evaluado, se puede llegar a cuestionar la validez del estudio.
- Hay empresas que han comunicado clinical holds por temas ligados a fabricación/proceso y solo pudieron avanzar tras resolverlos.
- Se pueden encontrar numerosas warning letters a sponsors por fallas básicas de supervisión/monitoreo en fase clínica .
Lo que proponemos en Soluciones GxP es el mínimo requerido desde el día 0: lo justo para bajar riesgo y acelerar, sin burocracia.
Empezamos con una reunión de diagnóstico: mapeamos su “cadena de evidencia” actual o prevista (preclínico–CMC–clínico), identificamos los riesgos que más pueden afectar a la empresa y les dejamos un plan priorizado según la etapa en la que se encuentre cada una.
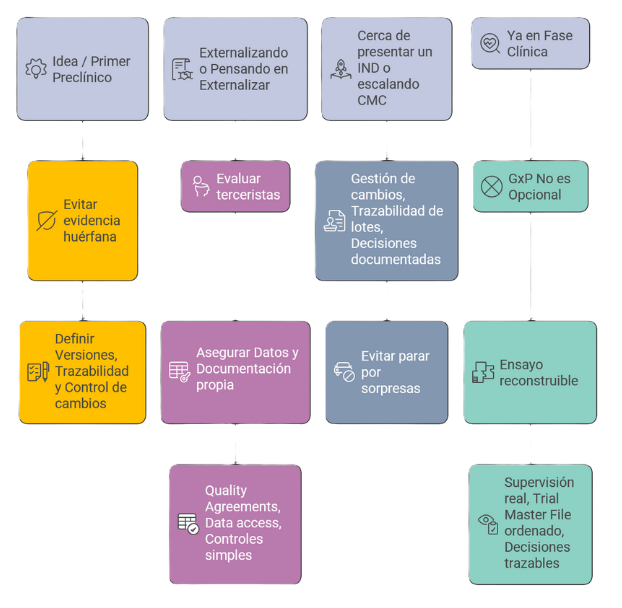
Nuestro apoyo en las diferentes etapas
- Si están en concepto / primer preclínico: GxP no es implementar un sistema enorme: es evitar que la evidencia nazca “huérfana”. Si hoy no definen versiones, trazabilidad y control de cambios, mañana no hay forma de convertir esos resultados en un paquete adecuado para un inversor, partner o regulador.
- Si están externalizando o pensando en externalizar (CRO/CDMO): El outsourcing no transfiere responsabilidad. Lo que hacemos es apoyarlos en la evaluación del tercerista y asegurar que generen datos y documentación que realmente le pertenezcan a la empresa y sean auditables: quality agreements, data access, y controles simples para que no se enteren tarde de los problemas.
- Si están cerca de presentar un IND o escalando CMC: Fortaleciendo gestión de cambios, trazabilidad de lotes y decisiones documentadas, se evita parar por “sorpresas” de fabricación o comparabilidad.
- Si ya están en fase clínica: GxP no es opcional porque el sponsor tiene obligaciones que no puede delegar. El objetivo es que el ensayo sea reconstruible: supervisión real, Trial Master File ordenado y decisiones trazables.
Los invitamos a coordinar una reunión de diagnóstico y enfocarla en el próximo hito concreto que se planteen. No para llenarlos de papeles, sino para que su ciencia sea defendible cuando empiece a ser evaluada por terceros.
Intellectual and design property of Soluciones GxP Infodynamics SAS
Copyright © 2017-2026 · Last modified August 2024 · All rights reserved

Redes sociales
Facebook
Instagram
LinkedIn
X.com